** المحاليل الحمضية **
& عدد الوظائف الحمضية : هو عدد أيونات الهيدروجين في الصيغة الأيونية للحمض
1. خاصيات الحموض :
أ. تأين الحمض :
تعلم أن الحمض يتكون من شق موجب H+ وشق سالب هو ( الجذر الحمضي ) , وعند حل الحمض في الماء يفترق الشقان عن بعضهما , وهذا ما يدعى بالتأين , إذا" تتأين الحموض في محاليلها المائية وتعطي أيون الهيدروجين الموجب وأيون سالب :
مثال : تأين حمض كلور الماء
![]()
تزداد قوة الحمض بازدياد نسبة تأين الحمض في محلوله المائي , وتتفاوت الحموض في قوتها لذلك تصنف إلى :
الحمض القوي :
هو الحمض الذي يتأين كليا" في الماء كحمض كلور الماء وحمض الأزوت وحمض الكبريت
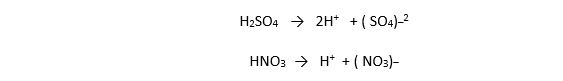
الحمض الضعيف :
هو الحمض الذي يتأين جزئيا" في الماء كحمض الخل وحمض الكربون
مثال تأين حمض الخل
![]()
ب. الناقلية الكهربائية للحموض : الحموض القوية أكثر ناقلية للكهرباء من الحموض الضعيفة
ج. المشعرات : هي مواد كيميائية يتغير لونها بتغير طبيعة الوسط ( حمضي أو أساسي ) فتدلنا على نوع هذا الوسط حمضيا" أو أساسيا" مثل : عباد الشمس , الفينول فتالئين , الهليانتين تغير الحموض لون مشعر عباد الشمس للأحمر
د. تأثير الحموض في المعادن :
تتفاعل الحموض مع معظم المعادن وينتج عنها ملح وينطلق غاز الهيدروجين









