لاحظنا سابقا أن هناك نوعانا" من الكهرليتات والتي تدعى بالكهرليتات الضعيفة وهي لا تتشرد كليا" في محاليلها بل تتشرد وبنسبة ضئيلة من جزيئاتها الكلية ( درجة تشرد صغيرة ) ويمكن تصنيف الماء مع الكهرليتات الضعيفة حيث أنه يتشرد بشكل ضعيف جدا" وفق التفاعل
![]()
حيث تدل القياسات التجريبية على أن شاردة الهيدروجين H+ ترتبط في المحلول المائي مع جزيء من الماء وتتشكل شاردة الهيدرونيوم H3O+ ، أي أن الماء يسلك سلوك الحمض والاساس في آن واحد ويحصل التوازن السابق ضمن مجال ضيق جدا" ويستدل على وجود مثل هذا التوازن في الماء النقي بقياس الناقلية
الجداء الشاردي للماء
يمكن تطبيق قانون فعل الكتلة على التفاعل المتوازن :
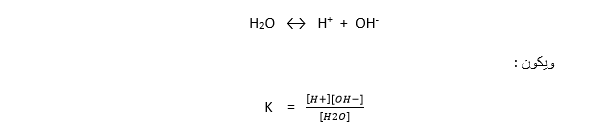
وفي الماء النقي أو المحاليل الممددة يمكن اعتبار تركيز الماء بشكل تقريبي ومقبول بأنه ثابت وبالتالي يمكن إدخاله في ثابت التوازن ونحصل على ثابت توازن جديد :
![]()
ويدعى الثابت الجديد بثابت الجداء الشاردي للماء ويرمز له بالرمز KW
![]()
وقد قيست قيمة KW بطريقة الناقلية فوجدت أنها تساوي إلى 1.0 × 10-14 وبالتالي يمكن قياس تركيز شوارد الهيدرونيوم H3O وشوارد الهيدروكسيل OH- في الماء النقي . حيث نلاحظ من معادلة تشرد الماء أنه من أجل مول واحد متشرد من الماء يقابله تشكل مول واحد من شوارد H+ ومول واحد من شوارد OH- , هذا يعني أن









