7-2-2-الانحلالية:
هي كمية الغاز مقدرة بـ m3 التي يمكن أن تنحل في 1m3 من السائل، وإن قابلية انحلال الغازات الهيدروكربونية في الماء قليلة، وخصوصاً عند القيم المنخفضة للضغط والحرارة، وإن وجود الأملاح في المياه و وجود الآزوت في الغاز يقلل من قيم الانحلالية، أما وجود غاز كبريت الهيدروجين و ثاني أكسيد الكربون يزيد من قيمتها بينما تكون الغازات الهيدروكربونية الثقيلة أقل انحلالية من الخفيفة في الماء، أما بالنسبة لانحلالية الغازات في النفط فهي أكبر بكثير من قيمتها في الماء ، و تزداد مع ازدياد الضغط حتى ضغط الإشباع و تحدد قيمتها من قانون (هنري) التالي :
![]()
حيث إن:
:Vg حجم الغاز المنحل في 1m3 من النفط.
:a معامل الانحلالية.
:VPحجم النفط الذي ينحل فيه الغاز عند الضغط P.
8-2-2- رطوبة الغاز:
وهي محتوى الغاز من بخار الماء حيث أن كمية بخار الماء التي يحتويها الغاز الطبيعي عند شروط مختلفة من الضغط ودرجة الحرارة يجب أن تكون معلومة من أجل التوصل إلى علاقة إنتاج الماء السطحي بأحجام مماثلة في المكمن، ويتم التعبير عن محتوى بخار الماء في الغاز بتعبيرين هما:
1-الرطوبة المطلقة: وهي كمية بخار الماء الموجودة في واحدة الحجم من الغاز وتقدر بواحدة gmlm3 أو Kgl1000m3
2-الرطوبة النسبية: كمية بخار الماء الموجودة فعلياً في واحدة الحجم من الغاز عند قيم معينة من الضغط والحرارة إلى الكمية العظمى التي يمكن أن يحتويها في حالة الإشباع عند نفس الشروط.
وبشكل عام تتعلق رطوبة الغازات الطبيعية بقيم الضغط والحرارة وتركيب الغاز وملوحة المياه المرافقة.
9-2-2-انفلات الغاز (فعل جول و طومسون):
خلال مسير الغاز من الطبقة إلى السطح ثم الفواصل فإنه سوف يمر من خلال تضيقات واختناقات وعبر المقاطع والتجهيزات، مما يؤدي إلى تغير في الضغط والذي سيرافقه تغير في درجة الحرارة نتيجة ضياع قسم من الطاقة للتغلب على قوى التجاذب الجزيئية ويتم ذلك دون حدوث أي تبادل حراري أو عمل مع الوسط الخارجي.
إن مقدار هذا التغير في درجة حرارة الغاز عند انخفاض الضغط بمقدار واحد ضغط جوي يسمى معامل جول- طومسون ويحسب هذا المعامل للغاز الطبيعي بالعلاقة التالية:
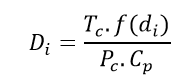
حيث إن:

10-2-2-تشكل الهيدرات (هيدرات الغاز الطبيعي):
عندما يكون الغاز في تماس مع الماء يحدث تشوه أو خلل للروابط الهيدروجينية في جزيئات الماء مما يؤدي إلى ازدياد الحجم المولي للماء ( الطبقة السطحية للماء ) ، ونتيجة التشوه الحاصل للروابط تنتج بنية متكهفة لجزيئات الماء و هذه البنية تعتبر مناسبة لامتصاص جزيئات الغاز ، عندما يبلغ عدد جزيئات الغاز قيمة معينة يحدث تغير طوري للماء كنتيجة للتغيرات في الطاقة الناجمة عن عمليات الامتصاص و كلما انخفضت درجة الحرارة و ازداد الضغط يزداد عدد جزيئات الغاز المحتواة في واحدة الحجم من طبقة السطحية للماء و في مثل هذه الظروف تتكون مركبات بلورية بيضاء نتيجة للاتحاد الفيزيائي للغاز الطبيعي مع الماء .
الظروف التي تساعد على تكوين الهيدرات هي التالية:
- وجود الغاز عند درجة حرارة أقل من نقطة الندى.
- وجود ضغط عالي.
- وجود المياه الحرة.
3-2-الخصائص الكيميائية و الترموديناميكية للغازات الطبيعية:
يمكن أن نذكر من أهم هذه الخصائص: الاحتراق، التفكك، قابلية الانفجار، الطاقة الحرارية، الحرارة النوعية...الخ.
1-3-2- الاحتراق (Combustion):
يحترق الغاز الهيدروكربوني معطياً غاز ثاني أكسيد الكربون و بخار الماء وفق المعادلة التالية :
![]()
عملياً تحترق الغازات الطبيعية بلهب أزرق و تتراوح درجة اشتعالها عند الضغط الجوي ![]() وتتناقص درجة الاشتعال بزيادة الضغط.
وتتناقص درجة الاشتعال بزيادة الضغط.
-2-3-2التفكك (Dissociation):
يتفكك الغاز الطبيعي بالتسخين معطياً الكربون والهيدروجين وفق المعادلة :
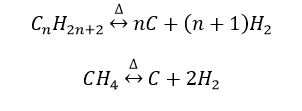
و يتعلق التفكك بشكل رئيسي بالضغط فـكلما ازداد الضغط تتناقص نسبة الغاز المتفكك .
-3-3-2قابلية الانفجار (Explosion):
تكون الغازات الطبيعية مع الهواء مزيجاً قابلاً للانفجار ، حيث يحدث الانفجار عند حدود معينة وذلك اعتباراً من قيمة صغرى معينة (الحد الأدنى لقابلية الانفجار) وحتى قيمة العظمى (الحد الأعلى لقابلية الانفجار). تتراوح حدود انفجار المزيج (غاز/هواء) عملياً بين (5-15%)، وتختلف هذه الحدود تبعا لجهة انتشار اللهب:
انتشار اللهب نحو الأعلى : حدودها ما بين (5 -15%)
انتشار اللهب نحو الأسفل : حدودها ما بين (6 -16.53%)
انتشار اللهب بشكل أفقي : حدودها ما بين (5.40 -14%)
تفيد دراسة هذا العامل في تلافي شروط تشكل هذا المزيج بحدوده الدنيا أو العظمى كعامل أمان عند التعامل مع الغازات المعالجة أو المنقولة أو المخزنة ومن ثم حماية العاملين من خطر الانفجار .
-4-3-2الطاقة الحرارية أو القيمة الحرارية (Heating Value) :
و تعبر عن كمية الحرارة المتحررة عن احتراق واحدة









