الفوسفور اللاعضوي (المعدني Pi)
يشكل الفوسفور المرتبط بالفلزات الأساسية والثانوية Pi والفوسفور المرتبط بالشكل العضوي 98-99 % من فوسفور التربة الكلي بينما يتواجد حوالي 1-2 % في أجسام التربة الحية , أما الشكل الذائب فيشكل 0.1 % فقط وهو متاح للامتصاص من قبل جذور النبات بشكل مباشر .
يشكل Pi عادة حوالي 35-70% من الفوسفور الكلي في الترب ، ويعتبر الـ Pi المتواجد بشكل أرثوفوسفات orthophosphate (H2Po4-,HPo42-,Po43-) مكون رئيسي لأكثر مخصبات التربة مع العلم أنه ليس كل أشكال الـ orthophosphate متاحة مباشرة للنبات ، المعادن الرئيسية للفوسفور هي الأباتيت والسترنجايت والفيرسايت مستقرة جداً ، على سبيل المثال الأباتيت أثبت كفاءة نسبياً لنمو المحاصيل في الترب الحامضية ، معادن الفوسفور الثانوية تتضمن فوسفات ( الكالسيوم والحديد والألمنيوم ) من بين الأشكال المعدنية للفوسفور يشكل الفوسفور المرتبط مع الكالسيوم Ca-P ، الفوسفور المرتبط مع الحديد Fe-P والفوسفور المرتبط مع الألمنيوم Al-P الكمية العظمى منها . ويصنف عموماً ضمن مجموعتين أساسيتين:
![]()
من بين فوسفات الكالسيوم : الفلور أباتيت (Ca10F2(PO4)6)، هيدروكسي أباتايت (Ca10(OH)2(PO4)6), أوكسي أباتايت (Ca10O(PO4)6)، كربونات أباتايت (Ca10CO3(PO4)6) والمتواجدين بشكل وفير في التربة وخاصة القلوية حيث تتواجد كربونات كالسيوم حرة، يدمص فيها الأرثوفوسفات (HPO4-- ، H2PO4-) على الكالسيت ، أما السترنجايت FePO4.2H2O والفيرسايت AlPO4.2H2O فيرتبطان مع الفوسفور المعدني ويتواجد عند pH تعادل 6- 6.5، ويكون فيها الفوسفور أكثر إتاحة للنبات عند هذه القيم . مع العلم أن جميع الترب المعدنية تحتوي على أكاسيد وهيدروكسيدات الحديد والالمنيوم والتي تتواجد كجزيئات منفصلة أو كطلاءات على جزيئات التربة الأخرى خاصة الطينية بالإضافة إلى معقدات هيدروكسيد الألمنيوم اللابللورية التي يمكن أن تتواجد في داخل طبقات سليكات الألمنيوم .
يتم انحلال الـ Pi مباشرة في منطقة التوازن بين كل من المترسب والمنحل، ويتوضح هنا دور درجة حموضة التربة في تأثيرها على انحلال الـ Pi بحسب نوع التربة . حيث يساهم زيادة قيم pH التربة (اللوغاريتم السالب لأيون الهيدروجين) في زيادة إتاحة الفوسفور للنبات ويعود السبب في زيادة قيم الـ pH هو تواجد أيونات Ca++ وتأثير السعة التنظيمية للبيكربونات HCO3- وأنيونات الأحماض العضوية الكربوكسيلية ومجموعات الـ OH- . يرتبط انخفاض pH التربة مع ظهور ارتفاع تراكيز Al+3 القابلة للذوبان ويساهم كلا العاملين في زيادة ادمصاص الفوسفور وانخفاض الـ P القابل للامتصاص من قبل النبات . ويمكن للنبات استخدام النواتج الذائبة من الـ Pi إما مباشرة أو بواسطة تعقيد تلك النواتج مع جسور عضوية Ligands في منطقة الانحلال ويكون أكثر قدرة على التوازن الكيميائي باتجاه انحلال الـ Pi . ولاننسى هنا ذكر الدور الهام لبعض البكتريا (مثل Bacillus,actinomycet, Pseudomonas) والفطريات (مثل Penicillum, Aspergillus) في انحلال Pi وهي متواجدة بكثرة في منطقة الريزوسفير .
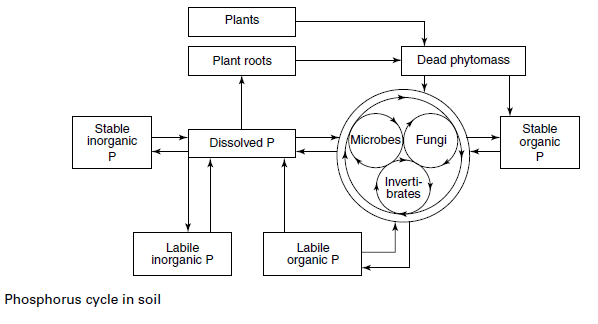
مخطط يوضح أشكال الفوسفور في التربة والعلاقات المتبادلة بين أشكاله
يتحرر الفوسفور المتاح بشكل عام منها من خلال التجوية بشكل بطيء جداً لتأمين متطلبات المحاصيل ، تختلف في معدلات انحلالها اعتماداً على :
- حجم الجزيئة المعدنية (حجم المركب الفوسفاتي حبيبات – بودرة – جيل .....)
- درجة الـ PH : مع زيادة PH التربة تزداد ذوبانية فوسفات الحديد والألمنيوم ولكن تنخفض ذوبانية فوسفات الكالسيوم باستثناء قيم الـ PH فوق ال 8 .
إن الشكلين الشاردين ذو الأهمية الكبيرة في محلول التربة هما H2PO4- , HPO4-2 وتتباين نسبتهما إلى بعضهما البعض تبعاً لدرجة الـ pH لمحلول التربة, فالتركيز العالي من شوارد H+ تدفع التفاعل نحو تشكل شوارد H2PO4- بحسب التفاعل التالي :
![]()
وبحسب الشكل التالي فان شوارد H2PO4- مسيطرة عند PH=5 وتغيب تقريبا شواردHPO4-2 , أما عند PH متعادل = (7) فان كلا الشاردتين متوفرتين في المحلول









