السلسلة الإنتقائية للكاتيونات :
تتعلق زيادة ألفة الكاتيونات للتبادل على سطوح التربة مع انخفاض قطر أيون الماء (التأدرت) وتترتب ضمن السلسلة التالية للكاتيونات الأحادية التكافؤ :
![]()
وتكون السلسلة الانتقائية للكاتيونات ثنائية التكافؤ (Deutsch ، 1997)
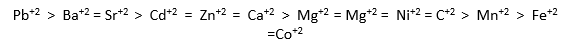
ومن اهم العوامل التي تلعب دور مهم في تحديد قابلية الكاتيونات للتبادل على سطوح التربة:
- طبيعة الكاتيون:
من المتفق عليه أن طبيعة الكاتيون من ناحية تكافؤه وتأدرته وعدده الذري تحدد القابلية الإستبدالية له . حيث ثبت بأن القوة الاستبدالية للكاتيونات تزداد بزيادة شحنتها , معنى هذا أن الكاتيون ثنائي الشحنة له قابلية استبدالية أعلى من الكاتيون الاحادي الشحنة والكاتيون الثلاثي الشحنة له قابلية استبدالية اعلى من الكاتيون الاحادي الشحنة والكاتيون الثلاثي الشحنة له قابلية استبدالية اعلى من الكاتيون الثنائي الشحنة ويمكن ترتيب الكاتيونات المختلفة التكافؤ بالشكل التالي:
M+< M++< M+++
حيث يرمز M للكاتيون.
وبناءً على معطيات الأبحاث السابقة يمكن تفسير سبب ذلك على النحو التالي:
أنه بالرغم من وجود علاقة طردية بين قوة جذب الكهربائي بين أسطح الغرويات وتكافؤ الكاتيون والتي تلعب دوراً رئيسياً في هذا المجال ، إلا أن ذلك يرتبط أيضاً بقابلية تحلل المركبات المتكونة على أسطح الغرويات نتيجة الادمصاص , أي المركبات المتكونة نتيحة اتحاد الكاتيون المدمص مع الجذور السالبة الشحنة المتواجدة في الطبقة المحددة لشحنة الغروية (AlO- ,SiO3- ,COO- ,OH-) ، حيث أن المركبات المتكونة مع الكاتيونات الأحادية الشحنة تكون أكثر تحللاً من المركبات المتكونة نتيجة ادمصاص الكاتيونات الثنائية الشحنة وهذه تؤكدها الحقيقة التالية , وهو أن الكاتيون الذي يتصف بقدرة استبدالية عالية ليس من السهل إزاحته بسهولة من سطح الغرويات.
تشير أكثر المصادر إلى أن الكاتيونات السائدة في التربة يمكن ترتيبها على النحو التالي:
اللثيوم Ni+ < الصوديوم Na+ < الهيدروجين H+ < البوتاسيوم K+ < الامونيوم NH+4 < المغنيزيوم Mg+2 < الكالسيوم Ca+2 < الالمنيوم Al+3 .
وبالطبع إن هذا الترتيب يعتمد على نوع الجسم الادمصاص (نوع الكاتيون المستخدم للمقارنة وتركيز المحاليل المستخدمة.
- طبيعة جسم الادمصاص :
إن القوة الاستبدالية للكاتيونات تعتمد ليس فقط على طبيعة الكاتيونات وإنما على طبيعة الجسم الذي يجري عليه التبادل . وقد ثبت ذلك من نتائج تجارب أجريت على غرويات (معادن) التربة المختلفة حيث لوحظ بوضوح أن هذه الغرويات تدمص الكاتيونات بدرجات متفاوته .
- تركيز المحلول:
تزداد قوة استبدال كاتيونات الصوديوم بالكالسيوم المغنيزيوم مع زيادة تركيز المحلول ، ثم أشارت الأبحاث اللاحقة إلى أن تأثير تركيز المحلول على التبادل الكاتيوني هو ليس علاقة بسيطة وإنما يرتبط بنوع الكاتيونات المتبادلة ، وطبقا لقانون فعل الكتلة فإن الكاتيون يشارك في التبادل بجذر تكافؤه ، مثال ذلك الكالسيوم يشارك في التبادل بالجذر التربيعي لتركيزه . لذلك نتوقع أنه في حالة التبادل بين الكاتيونات المتشابهه الشحنة فإن التخفيف أو التركيز سوف لايؤثر على نسبة الكاتيونين في الجزء الصلب . أما في حالة تبادل كاتيونين مختلفي الشحنة (مثلا الكالسيوم مع الصوديوم) فإن التخفيف يسبب نقصان في تركيز الصوديوم أسرع بكثير من النقصان في تركيز الكالسيوم . بعبارة أخرى إن التخفيف يؤدي إلى تشبع معقد التبادل بالكاتيون العالي الشحنة (الكالسيوم), والعكس بالعكس يعمل زيادة التركيز أي زيادة تشبيع معقد التبادل بالصوديوم . وقد أطلق على هذه السلوكية بتأثير التكافؤ- التخفيف . وتحمل هذه العلاقة أهمية كبيرة في استصلاح الترب الملحية والقلوية وكذلك عند استخدام المياه المالحة وتخفيفها عند غسل هذه الترب .
- نوع الكاتيونات المتبادلة المرافقة في معقد التبادل:
إن ازاحة أي كاتيون من معقد التبادل تعتمد ليس فقط على طبيعة وكمية هذا الكاتيون في معقد التبادل وتركيزه في المحلول وإنما على نوع وكمية الأيونات المرافقة له في معقد التبادل والمحلول أيضاً ، ويطلق تعبير الكاتيونات المتبادلة المرافقة على الكاتيونات الأخرى المتواجدة في معقد التبادل بالاضافة إلى الكاتيون المعدني . حيث إن معقد التبادل يحوي في معظم الترب على خليط من الكاتيونات التالية : البوتاسيوم والصوديوم والكالسيوم المغنيزيوم وكمية محسوسة من الهيدروجين وكميات قليلة جداً من الكاتيونات الأخرى ، لذلك يطلق على هذه الكاتيونات (باستثناء البوتاسيوم مثلاً) بالكاتيونات المتبادلة المرافقة للبوتاسيوم . لذلك يصبح من الضروري التعبير عن كمية الكاتيون المدمص ليس من خلال كميته المطلقة وإنما كميته النسبية .
- نوع الأنيون المرافق:
هناك اختلاف كبير في الصفات الأساسية للأيونات وخاصة من ناحية التكافؤ ونصف القطر والسرعة . وهذه الإختلافات يجب أن تتواجد أيضاً بين الأنيونات السائدة في الترب : الكلوريدات والكبريتات والهيدروكسيل والكربونات وإلى آخره من الأنيونات . لقد أشارت الأبحاث عند مقارنة لادمصاص الصوديوم من قبل التربة من مختلف المحاليل الصوديومية المختلفة . وتبين أن كمية الصوديوم المدمصة تعتمد على نوع الملح الصوديومي أو بعبارة أخرى على نوع الأنيون المرافق للصوديوم.
واستنتجت هذه النتائج أنه بالرغم من ان كمية الصوديوم المدمصة من محاليل الأملاح المتعادلة لا تختلف كثيراً، إلا أن كمية الصوديوم المدمصة من محلول كربونات الصوديوم وفوسفات الصوديوم أكثر من تلك المدمصة من محاليل الأملاح المتعادلة .
السعة التبادل الكاتيونية للجذور:
تختلف الأنواع النباتية بشكل كبير في مجال السعة التبادلية الكاتيونية للجذور CECR ، يتراوح مدى هذا الإختلاف بين 70 – 10 ملليمكافئ/100 غ مادة جافة . كما تعتبر النباتات أحادية الفلقة ذات سعة تبادل كاتيونية على جذورها بحوالي النصف مقارنة بنباتات ثنائية الفلقة ، وهناك دراسات تشير أن قيم السعة التبادل الكاتيونية على الجذور ذات عامل مؤثر على أسباب التباين والإختلاف في امتصاص العناصر وخاصة الفوسفور في النباتات لا بد من الإشارة أن قياس سعة التبادل الكاتيونية للجذور سوف تقيس تبادل الكاتيونات على الجذور الحية والميته مما يعطي بعض الوضوح في تأثير النوع النباتي والمعاملات المدروسة .
وعلى هذا من الطبيعي أن تتأثر عدد الكاتيونات المتبادلة على جذور النبات مع عدة عوامل ( عمر النبات ، مساحة سطوح الجذور ، تركيز العناصر في منطقة الرايزوسفير ، نوع التربة وقوامها ، نسبة الرطوبة في التربة ......ألخ) .
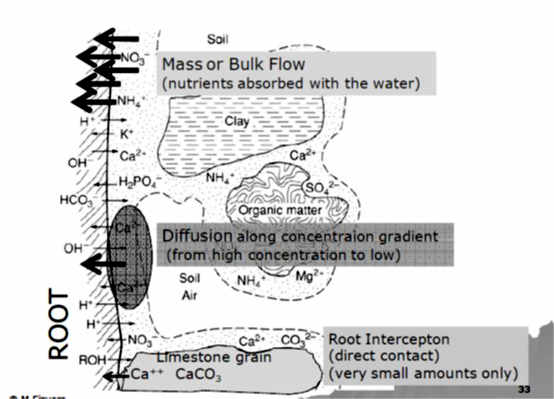
من المعلوم أن التبادل الكاتيوني يجب أن يتم بين الكاتيونات، لذا فإن النبات يحتاج لكاتيونات على سطوحه ليتم تبادلها مع كاتيونات أخرى ، وهنا يبرز دور بروتون الهيدروجين الذي تفرزه جذور النبات عبر









