نعلم أن الكهرليتات القوية يمكن أن تتشرد بشكل كامل في المحلول المائي مثال على ذلك المحلول المائي للملح CaCl2 بتركيز 0.01 M يتشرد بشكل كامل ويعطي 0.001 M من الشاردة Ca++ و 0.02 M من الشاردة Cl- ولا يتبقى في المحلول أي أثر للملح CaCl2 وهذا السلوك يمكن أن تتبعه جميع الكهرليتات القوية والتي لن نهتم بدراستها في ابحاثنا هذه . وتمتاز محاليل الكهرليتات القوية عادة بناقلية كهربائية عالية .
أما الكهرليتات الضعيفة فإنها لا تتشرد بشكل كامل في محلولها المائي وفي المحلول المائي لهذه المواد يحصل توازن كيميائي بين الكهرليت الضعيف الذي لم يتشرد وبين شوارده الموافقة في المحلول . أما الناقلية الكهربائية لمحاليل هذه الكهرليتات فتكون منخفضة نسبيا"
التوازن في محلول حمض ضعيف
مثال ذلك تشرد حمض الخل في الماء , إن هذا الحمض يتشرد بشكل جزئي في الماء ويكسب الماء صفات حمضية ضعيفة , حيث يحصل التوازن التالي بين الحمض وشوارده :
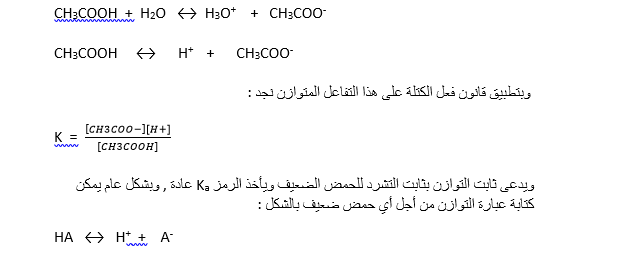
وثابت تشرد هذا الحمض يعطى بالعبارة :
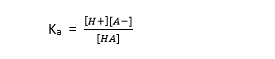
التوازن في محلول أساس ضعيف









