للماء النقي موصليّة كهربائيّة ضعيفة، ولكنّها تزداد عند إذابة كمّيّة قليلة من مادّة أيونيّة مثل كلوريد الصوديوم.
عند تطبيق طاقة كافية على الماء تفوق كمّيّة الحرارة القياسيّة للتكوين والتي تبلغ285.8 كيلو جول/مول (15.9 ميغا جول/كغ) يحدث عندئذ انفصال لجزيء الماء إلى مكوّناته من الهيدروجين والأكسجين، وهذا ما يحدث عند تطبيق جهد مرتفع من التيّار الكهربائي بشروط معيّنة للحصول على ظاهرة التحليل الكهربائي للماء. إنّ الطاقة اللازمة لفصل الماء إلى الهيدروجين والأكسجين عبر التحليل الكهربائي أو وسيلة أخرى تفوق الطاقة المستحصلة من تفاعل اتحاد العنصرين المذكورين. يمكن أن يتم التحليل الكهربائي للماء على مستوى تعليمي عبر جهاز هوفمان لتحليل الماء:
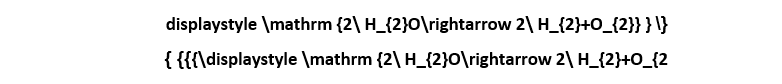
يصنّف الماء كيميائيّاً على أنّه أكسيد للهيدروجين، وهو يتشكّل عندما يحترق الهيدروجين أو أيّ مركّب حاوٍ عليه بالأكسجين، وهو مزيج انفجاري. تستطيع العناصر الكيميائيّة الأكثر كهرسلبية من الهيدروجين مثل الليثيوم والصوديوم والكالسيوم والبوتاسيوم والسيزيوم أن تزيح الهيدروجين من الماء مشكّلة بذلك الهيدروكسيدات الموافقة.
يوصف الماء بأنّه عَسِر عندما تكون نسبة الأملاح المعدنيّة في الماء عالية، وخاصّة أملاح الكالسيوم (Ca+2) والمغنسيوم (Mg+2)، بالإضافة إلى بعض الأملاح المنحلّة من البيكربونات والكبريتات، بالمقابل يوصف الماء غير العسر أنه "ماء يَسِر"، ويختلف تعريفه حسب الدولة، فهو الذي تركيزه من الأملاح أخفض من 100 مغ/ل في المملكة المتّحدة، وأخفض من









