*ادمصاص الفوسفور Phosphorus Sorption *
& تبقى أيونات الفوسفور المدمصة بحالة حركة مستمرة إما لداخل محلول التربة أو لخارجه باتجاه ركيزة الادمصاص Adsorbate، عندما يكون تركيز الفوسفور منخفضاً في محلول التربة (قد امتصه النبات Absorbtion) أو مرتفعاً (نتيجة عمليات التسميد المعدني والعضوي). لقد اعتبر Holford (1997) في دراسته أن الفوسفور المدمص هو المصدر الرئيسي للفوسفور اللاعضوي الذي يستخدمه النبات، ويحكم سرعة تحرره من السطوح المدمصة إلى النبات مروراً بمحلول التربة عامل السعة التنظيمية للفوسفور في التربة Soils Buffering Capacity . &
& يدمص الفوسفور اللاعضوي Pi بشكل أساسي على سطوح الطين، وبشكل ثانوي على مركبات جزيئات التربة (مثل أكاسيد وهيدروكسيدات الحديد والألمنيوم، كربونات الكالسيوم والمغنيزيوم) وعلى المادة العضوية ، هذا مع الإشارة إلى الاختلاف في درجة قوة الادمصاص والتي تقسم إلى ادمصاص كيميائي وادمصاص فيزيائي . كما ترتبط عدد مواقع الادمصاص بمحتوى الترب من المادة العضوية، التوزع النسبي لجزيئات التربة، وبدرجة التفاعل (pH) . &
& تختلف الآراء حول دور خصائص التربة في تفاعلات الادمصاص للفوسفور المضاف، حيث أن علاقة الادمصاص تختلف بشكل واسع بين الترب. إن لجميع العوامل المحددة لدرجة pH تأثير على تركيز الفوسفور في محلول التربة وكلاهما يتأثران بحسب خواص التربة (التركيب والقوام) ، النوع النباتي ودرجة إمدادها للعناصر المغذية الأخرى، كما أن للشروط البيئية السائدة (شروط إرجاع ، رطوبة التربة ، حرارة التربة) تأثير وبشكل معقد على معدل تمعدن وتعضد الفوسفور خلال العمليات الحيوية وغير حيوية التي تجري ضمن الريزوسفير. لخّص Hinsinger (2001) تأثير درجة pH بالتالي:
1_ يؤثر رقم pH على عدد مواقع ادمصاص الفوسفور وفي انحلال المعادن الأولية والرواسب .
2_ تركيز الأنيونات العضوية واللاعضوية والتي تتنافس مع أيونات الفوسفور على مواقع الادمصاص .
3_ تركيز معادن (Ca، Fe ،Al) وقدرتها على تشكيل روابط مع أيونات الفوسفور. &
**أولاً : في الترب الحامضية :**
& يدمص الفوسفور بقوة على أكاسيد وهيدروكسيدات الحديد والألمنيوم كالجبسيت والهيماتيت والجواتيت ، ويدمص الفوسفور أولاً على سطح معادن الطين وأكاسيد الحديد والألمنيوم بشكل معقدات مختلفة ـ المعقدات الجسرية السطحية البروتونية وغير البروتونية قد تتواجد عند PH =4 - 9 بينما المعقدات الجسرية البروتونية في النطاق الداخلي تسود في ظروف التربة الحامضية&
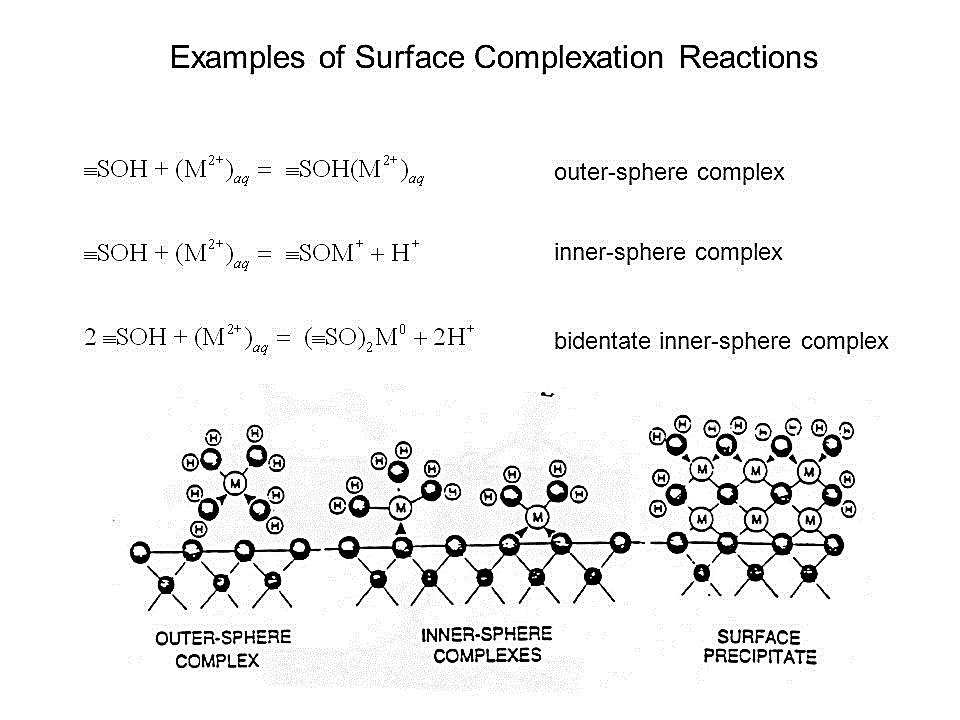
معادن الطين وأكاسيد الحديد والألمنيوم تمتلك مناطق ذات سطح نوعي كبير والتي توفر عدد كبير من مواقع الادمصاص , كما يمكن أن يزداد ادمصاص فوسفور التربة مع زيادة القوة الأيونية ومع تفاعلات أخرى .
ويمكن أن يُحبَس الفوسفور في المسامات النانوية والتي يتكرر ظهورها في أكاسيد الحديد والألمنيوم وبالتالي تصبح غير متاحة للنبات &
*الفوسفور في الترب الكلسية:*
& وضّحت الدراسات الأولية (Cole et al., 1953) أن طبيعة التفاعلات التي تشكل الأساس في عملية تثبيت الفوسفور المضاف هي تفاعلات (ادمصاص– ترسيب) وتتم على سطوح معقدات الكالسيوم، مع العلم بأنه من الصعب التمييز بينهما في منظومة التربة فقد يترافق فيها تفاعلات الادمصاص مع الترسيب. حيث تتوقف قيم الفوسفور المتاح للنبات وكفاءة استخدام الفوسفور من قبل النبات في الترب القلوية والكلسية على تشكل فوسفات الكالسيوم قليلة الذوبان عبر عمليات تثبيت الفوسفور المضاف ، تتشكل فوسفات كالسيوم غير ذائبة في الترب عالية المحتوى بـ كربونات الكالسيوم مع قيم pH بين ( 7 و 9 )، وفيها يتم تقييد الـ Orthophosphate القابل للذوبان ليتشكل فوسفات الكالسيوم المائية (CaHPO4.2H2O)، Octacalcium phosphate(OCP) (Ca4H(PO4)3.3H2O)، وهيدروكسي أباتيت (Ca10(PO4)6(OH)2. &
& يمكن إيضاح تحولات مركبات فوسفات الكالسيوم بدءاً من أكثرها ذوباناً وهو فوسفات الكالسيوم الأحادية Ca(H2PO4)2 وإلى الأصعب ذوبانا وهو الهيدروكسي أباتايت على الشكل التالي (الأصفري وآخرون، 1996):
Ca(H2PO4)2 + Ca2+ ↔ 2 CaHPO4 + 2H+
فوسفات الكالسيوم الثنائية (DCP) فوسفات الكالسيوم الأحادية
3 CaHPO4 + Ca2+ ↔ Ca4H(PO4)3 +2H+
فوسفات الكالسيوم الرباعية
Ca4H(PO4)3 + Ca2+ + H2O ↔ Ca5(PO4)3OH + 2H+
هيدروكسي أباتايت
& يتضح من توازنات هذه التفاعلات أن شوارد H+ تشجع على ذوبان فوسفات الكالسيوم في التربة بينما تؤثر شوارد Ca2+ بطريقة معاكسة، بحيث أن ذوبان مركبات الهيدروكسي أباتايت ضعيف للغاية في الماء وبدرجة أقل من ذلك بالنسبة للكلوروأباتايت Ca5(PO4)3Cl والفلوروأباتايت Ca5(PO4)3F . &









