المقدمة:
إن معرفة خصائص الغاز الطبيعي أمر أساسي في تصميم منظومات الإنتاج ومعالجة الغاز الطبيعي، لأن الغاز الطبيعي مزيج معقد من الهيدروكربونات الخفيفة مع كميات قليلة من المركبات اللاعضوية، حيث من المهم جداً معرفة مكونات الغاز الطبيعي لأنها تساعد على معرفة خصائصه.
ولابد من معرفة سلوكية وتركيب الغازات الطبيعية وبالتالي معرفة خصائصها الفيزوكيميائية والترموديناميكية وتعد الخطوة الرئيسية الأولى في كل العمليات الضرورية الهامة في الصناعة الغازية ابتداءً من عمليات تصميم أجهزة قعر البئر الغازي مروراً بعمليات إنتاج الغاز ومعالجته وتصميم أنابيب نقله وانتهاءً بعمليات توزيعه إلى المستهلكين.
2-2-الخصائص الفيزيائية والترموديناميكية للغازات الطبيعية:
تتمتع العناصر الغازية المؤلفة للغازات الطبيعية بخصائص فيزيائية مختلفة ومتغيرة فيما بينها ضمن مجالات واسعة جداً، وهذا ما يفسر سلوكية المختلفة لهذه العناصر في معظم عمليات الصناعة الغازية مقارنة مع سلوكية الغاز المثالي، لذلك من المهم جداً معرفة هذه الخصائص عند تصميم وتنفيذ عمليات الصناعة الغازية المختلفة.
ويمكن أن نذكر من أهم هذه الخصائص:
1-2-2-البارامترات الحرجة و الحرجة الزائفة:
تمثل معرفة البارامترات الحرجة والحرجة الزائفة أهمية صناعية كبرى وذلك عند تعيين الحالة الفيزيائية للمزيج الغازي، كما إنها تستخدم في تعيين قيمة عامل الانضغاطية Z.
وتمثل البارامترات الحرجة ما يلي:
- درجة الحرارة الحرجة: ويرمز لها ب Tc وهي بالتعريف درجة الحرارة التي فوقها لا يمكن للغاز أن يتميع، فمثلاً درجة الحرارة الحرجة للايتان
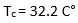
- الضغط الحرج: ويرمز له ب Pc وهو عبارة عن القيمة الدنيا للضغط الذي يمكن للغاز عنده أن يتميع فيما لو كانت درجة حرارته موافقة لدرجة الحرارة الحرجة Tc
فالضغط الحرج للايتان ![]() وهذا يعني أنه عند ضغط أعلى من 48.16 atm ودرجة حرارة أعلى من 32.2 C° لا يمكن للايتان أن يتميع.
وهذا يعني أنه عند ضغط أعلى من 48.16 atm ودرجة حرارة أعلى من 32.2 C° لا يمكن للايتان أن يتميع.
|
اسم العنصر |
الصيغة الكيميائية |
Pc (Bar) |
Tc (K) |
Vc (m3/kg) |
|
الآزوت |
N2 |
33.93 |
126.16 |
0.00318 |
|
ثاني أكسيد الكربون |
CO2 |
73.83 |
304.20 |
0.00214 |
|
ثاني أكسيد الكبريت |
SO2 |
78.85 |
430.66 |
0.00190 |
|
كبريت الهيدروجين |
H2S |
89.63 |
373.56 |
0.00284 |
|
الميتان |
CH4 |
46.40 |
190.66 |
0.00617 |
|
الإيتان |
C2H6 |
48.62 |
305.43 |
0.00488 |
|
البروبان |
C3H8 |
42.65 |
370.00 |
0.00453 |
|
إيزو البوتان |
i-C4H10 |
36.47 |
408.14 |
0.00445 |
|
نظامي البوتان |
n-C4H10 |
37.96 |
425.17 |
0.00438 |
|
إيزو البنتان |
i-C5H12 |
33.33 |
460.96 |
0.00423 |
|
نظامي البنتان |
n-C5H12 |
33.74 |
469.78 |
0.00421 |
|
إيزو الهكسان |
i-C6H14 |
30.34 |
498.06 |
- |
|
نظامي الهكسان |
n-C6H14 |
30.31 |
507.86 |
- |
|
نظامي الهبتان |
n-C7H16 |
27.36 |
540.17 |
- |
الجدول يوضح البارامترات الحرجة لبعض عناصر المزيج الغازي.
ويجب الإشارة أنه عند التعامل مع المزائج الغازية يتم استخدام البارامترات الحرجة الزائفة Pseudo-critical)) بدلاً من البارامترات الحرجة، إذ يمكن تعيين البارامترات الحرجة الزائفة للمزيج الغازي باستخدام العلاقات التالية:
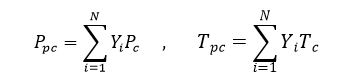
و لكن عندما يتعذر علينا معرفة تركيب المزيج الغازي يمكن تعيين البارامترات الحرجة للمزيج الغازي بالاستعانة بالعلاقات (A.Z.Istomin ) التالية :
![]()
حيث إن Δ الكثافة النسبية للغاز.
2-2-2البارامترات المرجعة و المرجعة الزائفة:
يمكن التعويض عن البارامترات الأساسية (P,V,T) والتي تصف حالة غاز ما بالنسبة بين القيم المطلقة والقيم الحرجة لكل بارامتر من البارامترات المذكور أعلاه، عندئذ يمكن أن نحصل من أجل هذا الغاز المدروس على بعض القيم المسماة بالبارامترات المرجعة كما يلي:
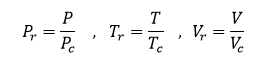
وبناء عليه يكون لجميع الغازات نفس معادلة الحالة عندما يتم التعبير عنها من خلال بارامتراتها المرجعة، أي:
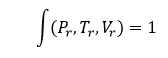
وتعرف هذه المعادلة بمعادلة الحالات المتناظرة، ولكن نظراً للأخطاء التي تعطيها هذه النظرية، فقد تم اعتبارها نظرية تقريبية ذات دقة كافية نسبياً وذلك من الغازات ذات التراكيب الكيميائية المتقاربة.
أما بالنسبة للمزائج الغازية يتم الاستعاضة عن البارامترات المرجعة بالبارامترات المرجعة الزائفة، والمعرفة كما يلي:
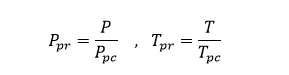
3-2-2-كثافة الغازات Gas Density:
كثافة المادة بالتعريف هي النسبة بين المادة في حالة السكون إلى حجمها. وتقاس الكثافة في الجملة الدوليةSi بالكيلوغرام على المتر المكعب Kglm3 أما في الوحدات الإنكليزية تقاس ب lblft3.
تتعلق كثافة غاز ما بشكل رئيسي بالضغط ودرجة الحرارة التي يتواجد عندها هذا الغاز في الشروط النظامية يمكن تحديد كثافة الغاز بمعرفة كتلتها الجزيئية M من العلاقة التالية:
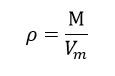
حيث إن:









