ا لتحديدات الأساسية و مواصفات الهواء الرطب:
قبل البدء بالحديث عن ترموديناميك الهواء الرطب ولفهم الأسس الترموديناميكية بشكل جيد نستعرض بإيجاز شديد بعض القوانين والتعريفات الخاصة بالغازات المثالية أي لا بد من العودة إلى شرح بعض المفاهيم والقوانين في علم الترموديناميك، من هذه القوانين:
القانون الأول للترموديناميك (قانون انحفاظ الطاقة ):
انطلاقاً من المقولة المستقاة من الخبرة العملية "الطاقة لا تفنى و لا تخلق من العدم" أو بعبارة أخرى " مجموع كمية الحرارة و العمل للقوى الخارجية الطبقة على الجسم العامل في عملية ترموديناميكية بسيطة يساوي تغير طاقة الجسم " أو بصياغة مماثلة " الحرارة المضافة إلى جملة ترموديناميكية مغلقة مع بقاء حجم الجملة ثابتاً تستهلك في رفع الطاقة الداخلية " أي أن تأثير الحرارة في جملة ما مماثل للأثر الذي ينشأ عن تقديم عمل ميكانيكي فالحرارة و العمل مقداران متكافئان (نظرياً):
![]()
حيث: dK,dU,dL,dQ هي بالتتابع : تغير كيمة الحرارة و العمل و الطاقة الداخلية و الطاقة الحركية .
قانون بول ماريوت:
ينص هذا القانون على أن "جداء الضغط بالحجم النوعي بثبوت درجة الحرارة هو مقدار ثابت " أي:
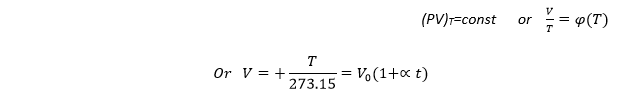
قانون أفوغادو :
ينص على أنه " عند نفس الضغط و درجة الحرارة و في حجم ثابت تمتلك جميع الغازات العدد نفسه من الجزيئات " أو أن " الحجوم الكيلومولية للغازات المختلفة عند الضغوط نفسها و درجات الحرارة متطابقة فيما بينها " أي:

قانون مندلييف – كلابيرون :
يدعى أيضاً المعادلة التفاضلية للغاز المثالي أي:
![]()
العملية الأديباتية:
هي العلمية الترموديناميكية التي تتم من دون تبادل حراري مع الوسط الخارجي (بدون قبول أو إعطاء حرارة):
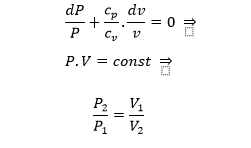
العملية الإنتروبية:
هي العملية الترموديناميكية التي تكون عندها علاقة تغير الطاقة الداخلية وكمية الحرارة ثابتة في كامل زمن جريان العملية (تعريف الإنتروبي: هو مقدار شامل مميز للحالة يستخدم كمقياس لتحديد عدم العكوسية للعمليات الترموديناميكية وتعيين اتجاه سيرها مسبقاً أو : الإنتروبي هي تابع وحيد الاتجاه للحالة " وهذا أحد صيغ القانون الثاني للترموديناميك" أما بحسب النظرية الجزيئية –الحركية فالانتروبي هي " معيار لعدم التعيين للأجسام و الجمل" ):

القانون الثاني للترموديناميك:









