- إعادة ترسب كبريتات الكالسيوم :
الصخور الكربوناتية والدولوميتية أو تلك التي تحوي ترسبات كربوناتية فإنها تحوي كبريتات الكالسيوم . إما بشكل أنهدريت (CaSO4) أو بشكل جص ( CaSO4 . 2H2O ) . كبريتات الكالسيوم هذه تنحل في السائل الحمضي ولكنها تعود وتترسب مرة أخرى بشكل جص أو أنهدريت حسب درجة الحرارة وببلورات ذوات أحجام أكبر من الأحجام التي كانت تشغلها في البداية وبالتالي فإنها تؤدي إلى إغلاق القنوات التي جرى توسيعها بالحامض أي أنها تؤدي إلى تقليل النفوذية المطلقة للطبقة وحتى إذا كانت تركيزها قليل جدا في الطبقة فإنها ذات تأثير ملحوظ على النفوذية المطلقة للطبقة السبب الرئيسي لترسب كبريتات الكالسيوم هو تغير قيمة PH للسائل الحمضي المستهلك ، هذه الكبريتات تتشرد حسب المعادلة الآتية :
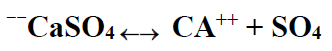
انحلال الكبريتات يعرف بالجداء بين تراكيز الشوارد وثابت التشرد عند درجة الحرارة 18 درجة سلسيوس هو الآتي :
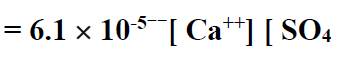
إن تناقص تركيز أي من هذه الشوارد [++Ca] أو [ SO4-- ] يؤدي إلى انحلال كميات جديدة من كبريتات الكالسيوم ( CaSO4) . للحفاظ على تعادل الشوارد .
عند ضخ السائل الحمضي في الصخر الذي يحوي میاه مشبعة بكبريتات الكالسيوم فإنه يحدث خللا في توازن الانحلال نتيجة ظهور التفاعل الاتي :
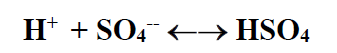
وحسب تعريف ثابت التشرد للمرحلة الثانية لحمض الكبريت فإننا نحصل على :
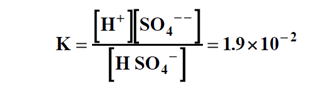
ضخ السائل الحمضي يزيد من تركيز شوارد الهيدروجين [ +H ] وهذا بدوره يؤدي إلى تناقص شوارد [HSO4- ] و[SO4-- ] كي يحافظ ثابت التشرد على قيمته . ولكن تناقص شوارد الكبريتات [SO4-- ] يؤدي إلى تزايد الجداء [+ + Ca ] [ SO4-- ] حتى يصل إلى 5 - 10×6.1
مع استهلاك الحمض في الطبقة فإن [ HSO4- ] يتشرد مولدة شاردة الهيدروجين [H+] معقبة بالتفاعل مع الكربونات والبيكربونات على الشكل التالي :
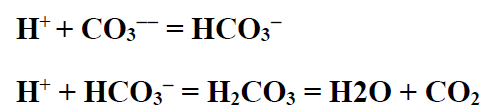
ذلك لأن كلا منHCO3- و H2CO3 هي حموض أضعف من HSO4- والنتيجة هي تشكل [SO4-- ] الذي يؤدي إلى زيادة الجداء [ Ca++ ] [SO4-- ] عن 5 - 10×6.1 ولإعادة التفاعل فإن تركيز شوارد الكالسيوم [++Ca ] يجب أن يتناقص وهذا يتم بترسبها بشكل Ca SO4 .
لتلافي ترسب كبريتات الكالسيوم وبالتالي لتلافي تأثيرها السلبي على عملية التحميض ينصح باتخاذ الإجراءات التالية :
- إعادة سحب السائل الحمضي من الطبقة قبل استهلاكه الكلي لأن درجة انحلال كبريتات الكالسيوم يتناسب عكس و PH أي كلما قل ال PH ازداد انحلالها وبالعكس .
- استعمال بعض المركبات التي تتفاعل مع كبريتات الكالسيوم المترسبة وتبقيها منحلة في الماء مثل فوسفات الصوديوم السداسية PO3 Na )6 )
ج- إضافة كلور الكالسيوم إلى السائل الحمضي الذي يمنع انحلال كبريتات الكالسيوم في الحمض .
- إعادة ترسب السيليكات:
عند استعمال مزيج من حمض كلور الماء HCl وفلور الماء HF لمعالجة الطبقات الرملية وخاصة لتلافي انتفاخ الغضار فإن حمض فلور الماء يتفاعل مع الصخر وفق المعادلات والتفاعلات التالية :
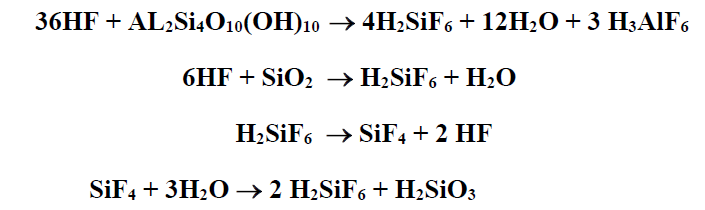
هذا المركب الأخير 3H2Si0 يترسب جزئيا وبشكل جيلاتين مؤدية إلى إغلاق بعض قنوات جریان الموائع في الطبقة وبالتالي مقلة النفوذية الفعلية لهذه الطبقة .
كذلك فإن حمض فلور الماء يتفاعل مع الصخور الكربوناتية والدولوميتية معطية فلور الكالسيوم









