كما نعلم أن تشكل الأملاح هو عبارة عن ناتج تفاعلات التعادل بين الحموض والأسس . مثال ذلك ملح كلور الصوديوم NaCl ( تعديل حمض قوي بأساس قوي ) ، وملح خلات الصوديوم NaCH3COO ( تعديل حمض ضعيف بأساس قوي ) وكذلك ملح كلور الأمونيوم NH4Cl ( تعديل حمض قوي بأساس ضعيف ) ، وأخيرا" ملح خلات الأمونيوم NH4CH3COO ( تعديل حمض ضعيف بأساس ضعيف ) . وعند إضافة هذه الأملاح إلى الماء نلاحظ أن PH محاليل هذه الأملاح تتغير تبعا" لنوعية المحلول الملحي . مثال ذلك أن PH محلول كلور الصوديوم يساوي تقريبا" 7 ، بينما محلول خلات الصوديوم له PH أكبر من 7 و PH محلول كلور الأمونيوم أقل من 7 ، فكيف يمكن تفسير هذا الاختلاف في PH محاليل هذه الأملاح ؟
عندما ينحل الملح في الماء فإنه يتشرد في الماء إلى شوارد موجبة وشوارد سالبة والتي بدورها يمكن أن تتفاعل مع الجسم المحل ( الماء ) ويمكن أن تتحرر بموجب هذا التفاعل شوارد H+ أو شوارد OH- وفق التفاعلين :
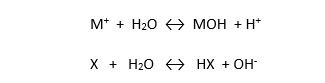
وتدعى هذه التفاعلات بالحلمهة . وبالتالي فإن PH المحلول يعتمد على تركيز كل من شوارد الهيدروجين وشوارد الهيدروكسيل المتحررة وأيهما أعلى تركيز .
لنعتبر محلولا" لملح كلور الصوديوم ( ناتج عن تفاعل حمض قوي بأساس قوي ) إن هذا الملح عندما يتفاعل مع الماء يمكن أن يشكل الحمض القوي HCl والأساس القوي NaOH ، وكلاهما من الكهرليتات القوية وبالتالي يتشردان بصورة كاملة من جديد في الماء , وبالنتيجة تتشكل شوارد متساوية في التركيز لكل من H+ و OH- في المحلول أي أن PH المحلول تكون مساوية إلى 7 .
نتيجة
إن الشوارد الموجبة أو السالبة ، للأسس القوية والحموض القوية على الترتيب لا تعاني من حادثة الحلمهة ، وبالتالي الملح المتشكل عن تفاعل حمض قوي مع أساس قوي يشكل محلولا" معتدلا" PH =7 .
حلمهة ملح لحمض ضعيف وأساس قوي ( حلمهة الشرسبة )
مثال ذلك حلمهة ملح خلات الصوديوم NaCH3COO في هذه الحالة شاردة الخلات ( الشرسبة ) ه









