4-2-2-الكثافة النسبية (Relative Density):
هي النسبة بين كثافة الغاز وكثافة الهواء عند نفس شروط الضغط ودرجة الحرارة
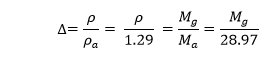
في حين يتم حساب الكثافة النسبية لمزيج غازي من خلال العلاقة: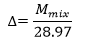
|
اسم العنصر |
الصيغة الكيميائية |
الكتلة المولية |
الكثافة النظامية
|
|
الآزوت |
N2 |
28.016 |
1.250 |
|
ثاني أكسيد الكربون |
CO2 |
44.011 |
1.965 |
|
الأوكسجين |
O2 |
32.000 |
1.429 |
|
كبريت الهيدروجين |
H2S |
34.076 |
1.521 |
|
الهيدروجين |
H2 |
2.016 |
0.090 |
|
الميتان |
CH4 |
16.042 |
0.716 |
|
الإيتان |
C2H6 |
30.068 |
1.342 |
|
البروبان |
C3H8 |
44.094 |
1.968 |
|
إيزو البوتان |
i-C4H10 |
58.12 |
2.595 |
|
نظامي البوتان |
n-C4H10 |
58.12 |
2.595 |
|
إيزو البنتان |
i-C5H12 |
72.146 |
3.220 |
|
نظامي البنتان |
n-C5H12 |
72.146 |
3.220 |
|
إيزو الهكسان |
i-C6H14 |
86.172 |
3.847 |
|
نظامي الهكسان |
n-C6H14 |
86.172 |
3.847 |
|
نظامي الهبتان |
n-C7H16 |
100.198 |
4.473 |
الجدول يبين الكتلة المولية والكثافة النظامية لبعض العناصر الغازية.
5-2-2-عامل الانضغاطية (Compressibility factor):
سلوك الغازات الحقيقية ينحرف عن سلوك الغازات المثالية حسب التجارب المخبرية حيث إن الانحراف يزداد بزيادة الضغط وانخفاض درجة الحرارة التي يتواجد عندها الغاز المدروس كما في الشكل (1-2)، ويتم التعبير عن الانحراف بالعامل (Z) المسمى بعامل انحراف الغازات الحقيقية عن القانون العام للغازات المثالية أو بعامل الانضغاطية أو اللامثالية.
تعتبر المعادلة العامة للغازات المثالية عملياً وسيلة مرضية في تعيين بعض الخصائص الفيزيائية للغازات ذات الضغوط المنخفضة، في حين يمكن أن يؤدي تطبيق هذه المعادلة على الغازات ذات الضغوط المرتفعة إلى ارتيابات وأخطاء كبيرة.
بقسمة معادلة الحالة للغازات الحقيقية على معادلة الحالة للغاز المثالي من أجل m Kg ينتج لدينا:
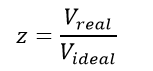
وبناءاً على ما سبق يمكن تعريف عامل الانضغاطية بأنه النسبة بين الحجم الحقيقي الذي تشغله كتلة معينة من الغاز عند ضغط ودرجة حرارة محددين إلى الحجم الذي تشغله الكتلة نفسها عند الشروط نفسها إذا تصرف الغاز على نحو مثالي.
وتعتمد قيمة عامل الانضغاطية بشكل رئيسي على تركيب وصفات النظام الغازي، الضغط، درجة الحرارة، ولا تتعلق بكمية الغاز المدروس. ويمكن تعيين قيمة عامل الانضغاطية إما باستخدام المنحنيات البيانية أو باستخدام بعض العلاقات الرياضية.
1-5-2-2-تعيين عامل Z باستخدام المنحنيات البيانية ذات الشكل ![]() :
:
يمثل هذا العامل انحراف سلوك الغازات الحقيقة عن سلوك الغازات المثالية بالعلاقة مع شروط الضغط و درجة الحرارة، و يمكن تحديده كتابع للضغط المنخفض و درجة الحرارة المنخفضة (ضغط مرجعPr، درجة حرارة مرجعة Tr) و ذلك من خلال منحنيات (standing and Katz) الشكل
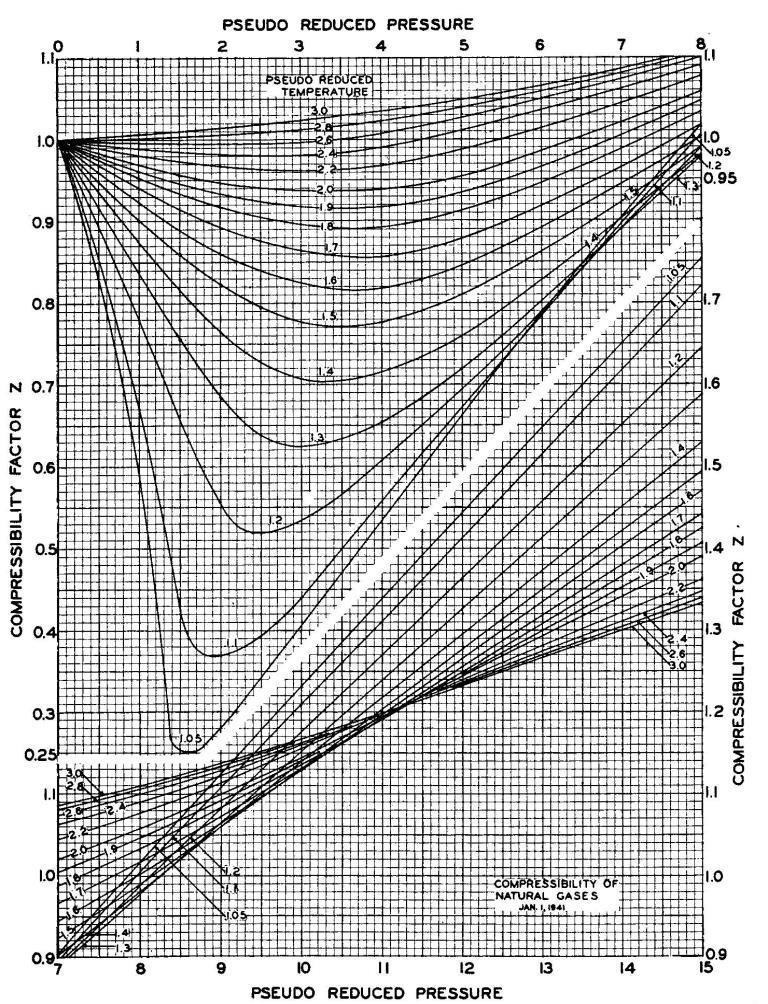
الشكل standing and Katz يبين عامل الانضغاطية Z بالعلاقة مع الضغط
درجة الحرارة المرجعين (المخفضين).
و تجدر الإشارة بأن قيمة هذا العمل من أجل الغازات المثالية هي Z = 1
2-5-2-2-طريقة تعيين عامل الانضغاطية Z باستخدام العلاقات الرياضية:
تفتقر قيمة عامل الانضغاطية المقروءة من المنحنيات البيانية إلى الدقة الكافية ولهذا السبب تم اعتماد مجموعة من العلاقات الرياضية التجريبية ذات الشكل![]() و يمكن أن نذكر منها:
و يمكن أن نذكر منها:
-علاقة Berthelot:
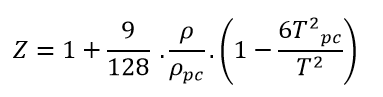
وبمراعاة قيمة الضغط المرجع الزائف ودرجة الحرارة المرجعة الزائفة، يمكن كتابة العلاقة السابقة على النحو التالي:
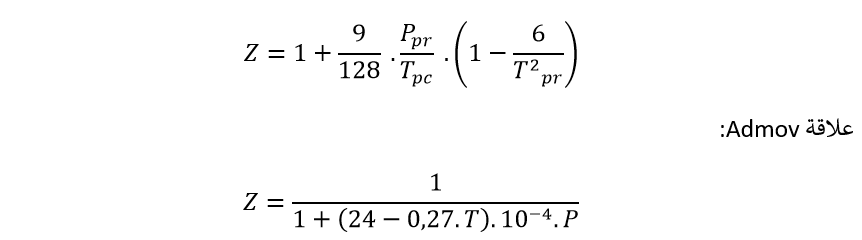
حيث إن:
T : درجة حرارة الغاز C°
P : ضغط الغاز bar
3-5-2-2-تأثير المركبات الغير الهيدروكربونية في عامل الانضغاطية:
من المعلوم أن الغازات الطبيعية تحتوي بالإضافة للمركبات الهيدروكربونية، مركبات غير هيدروكربونية كالآزوت، وثاني أكسيد الكربون، وغاز كبريتيد الهيدروجين، لكن عندما تتجاوز قيمة الكسر المولي لأحد هذه الغازات أو مجموعهما 10% فمن المستحسن عدم اللجوء إلى استخدام علاقات الرياضية السابقة في تعيين قيمة عامل الانضغاطية لأنها يمكن أن تؤدي إلى أخطاء كبيرة لا يسمح بها في الصيغة الغازية.
لقد قام العالمان (Wichert and Aziz) بتعريف كل من الضغط الحرج الزائف المصحح ودرجة الحرارة الزائفة المصححة كل ما يلي:









